 首页
首页 我的学习
我的学习 我的
我的癫痫发作通常与一个共同的潜在病理生理学有关:神经元过度活跃。因此,大多数治疗干预措施旨在通过手术去除异常信号区域,或使用药物干预降低神经元动作电位。
不幸的是,只有 2/3 的患者癫痫发作完全缓解。这表明需要新的、更有效的治疗方法。为此,基于细胞的疗法代表了一种实验性的外科手术干预。
.
干细胞是治疗癫痫的一个有吸引力的选择,因为它们有潜力替代受损细胞、恢复认知功能和稳定局灶性电活动。
早期动物模型显示出限制局灶性癫痫发作持续时间和频率的潜力,这可能会改变药物难治性癫痫患者的生活,因为它提供了一种侵入性或刺激技术的替代方法。
事实上,使用干细胞比某些刺激控制技术具有明显的优势,因为干细胞不需要实时检测癫痫发作来传递治疗抑制信号。
.
.
将从外侧神经节隆起收集的胚胎纹状体前体细胞移植到诱发癫痫持续状态 (SE) 的成年大鼠体内,可在 SE 后 12 个月内将自发性复发性重度运动性癫痫发作的频率降低高达 89%。这可能是因为移植物中存在抑制性 GABA 能神经元,它们可以控制后续癫痫发作的频率和强度。
这些结果仅着眼于重度运动性癫痫发作的改善,但后来发现,移植 GABA 祖细胞也可以降低脑电图癫痫发作的频率,同时还具有恢复攻击性和多动症等行为缺陷的额外好处。
有证据表明,干细胞疗法的益处还延伸到 stargazer 小鼠模型中观察到的失神性癫痫。将内侧神经节隆起 (MGE) 细胞移植到小鼠的初级视觉皮层会产生显著的突触后抑制电流,有望用于治疗失神性癫痫。
事实上,与对照的 Stargazer 小鼠相比,移植了 MGE 细胞的 Stargazer 小鼠模型的失神性癫痫得到了显著缓解,并且在钾诱发的兴奋性挑战期间,其初级视觉皮层的兴奋性显著降低。
.
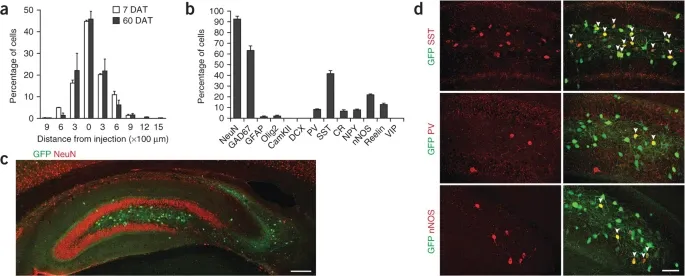
移植的 MGE 细胞迁移到成人海马并表达抑制性神经元的标志物
.
到目前为止讨论的结果仅限于小鼠模型和小鼠来源的细胞移植物,但使用人类细胞(尽管研究得少得多)也能产生类似的结果。
例如,人类胎儿成纤维细胞可以在体外转化为诱导神经元细胞并随后成熟,移植到成年大鼠体内后,短期内能够保持强劲的存活率。
同时,移植到大鼠海马中的胎儿人类成纤维细胞来源的诱导神经元逐渐成熟,并显示出强大的功能性并整合到移植部位。这凸显了使用诱导神经元细胞移植物作为细胞替代疗法的潜在人类干细胞来源的可行性。
.



全部评论