 首页
首页 我的学习
我的学习 我的
我的过敏反应是免疫系统对无害物质(过敏原)的无用反应,是耐受性未能形成的结果。
近年来,通过对过敏的细胞和分子基础的了解,新的治疗方法正在出现,这些方法试图作用于过敏的潜在致病机制并提供长期效果。
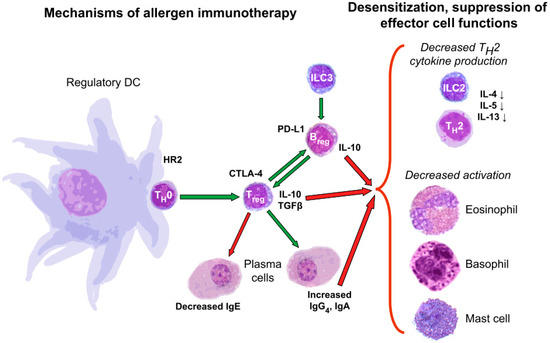
抗原特异性免疫疗法产生耐受性的机制示意图
促进对过敏原的耐受性是这些方法的目标。
一方面,一旦了解了主要的过敏因素,一些疗法就会尝试通过将细胞反应重定向到耐受状态或通过外源转移耐受细胞或其分泌体来调节免疫反应。
另一方面,过敏原特异性免疫疗法 (AIT) 旨在通过让患者接触少量、逐渐增加的过敏原剂量来实现过敏原耐受性。
树突状细胞是最专业的抗原呈递细胞 (APC),被认为是先天免疫和适应性免疫之间的连接点。它们充当启动和调节免疫反应的哨兵细胞。
根据树突状细胞的成熟/激活状态和谱系标志物的表达,树突状细胞还被证实可通过抑制 T 细胞反应来诱导耐受状态,具体方式包括凋亡、无能、产生调节性 T (Treg) 细胞和分泌免疫抑制细胞因子。
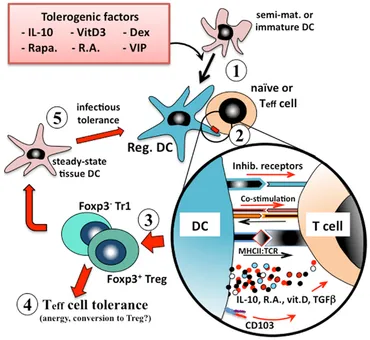
调节性树突状细胞诱导免疫耐受
在过敏反应中,使用天然或诱导的耐受性树突状细胞 (tDC) 可作为控制加剧的免疫反应的一种预防和治疗方法。
分离和重编程树突状细胞以使其具有耐受性特征的技术已得到很好的描述,后者包括用一些细胞因子如转化生长因子 (TGF)-β、白细胞介素 (IL)-10 和如皮质类固醇或雷帕霉素的药物治疗。
有研究表明,将骨髓来源的树突状细胞在体外暴露于 IL-10 并转移到卵清蛋白 (OVA) 诱导的过敏小鼠体内,可降低气道高反应性、嗜酸性粒细胞增多和 Th2 细胞因子释放。
同样,经过基因改造以表达 IL-10 的骨髓来源的树突状细胞可抑制实验性哮喘诱导。
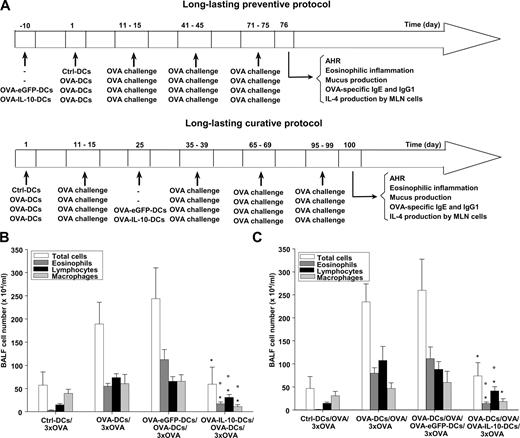
OVA-IL-10-DCs 的持久预防和治疗效果
B 淋巴细胞在过敏中发挥着关键作用,因为它们终末分化为过敏原特异性免疫球蛋白 (Ig)E 分泌浆细胞。
IgE 是引起过敏反应的抗体,在血液中含量最少的免疫球蛋白,但却是对抗寄生虫病(主要是由蠕虫引起的寄生虫病)的主要抗体。
实验证明,长期接触过敏原可能导致骨髓中长寿的 IgE 浆细胞积聚,从而随着时间的推移保持过敏记忆。
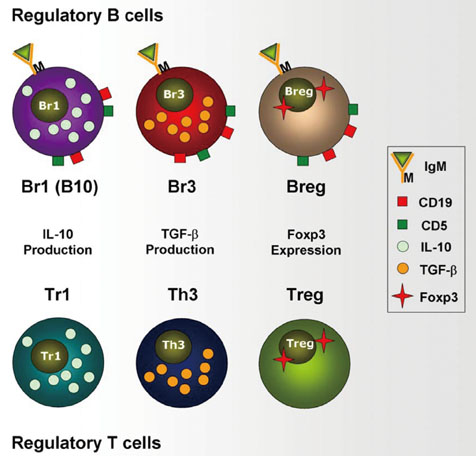
调节性 B 细胞和 T 细胞。
相反,有一部分 B 细胞通过表面分子和细胞因子的分泌对免疫反应起抑制作用。这些调节性 B(Breg)细胞在过敏抑制中的作用已得到充分证实。
研究发现,过敏性鼻炎和过敏性哮喘患者的 B 细胞中 Breg 细胞亚群的比例较低,而过敏原免疫疗法可提高产生 IL-10 的抗原特异性 B 细胞的频率。
研究表明,在小鼠过敏性哮喘模型中,Breg 细胞的过继转移可通过 IL-10 依赖的方式使气道炎症和肺功能正常化。
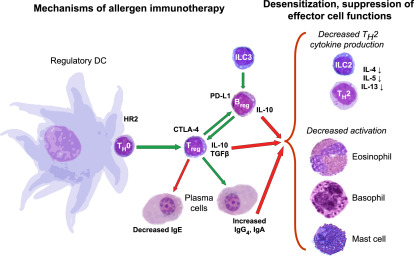
过敏原免疫治疗的基本机制概述
易感人群对过敏原致敏后,循环过敏原特异性 IgE 通过细胞表面的高亲和力 IgE 受体 (FcεRI) 与肥大细胞 (MC) 结合。
肥大细胞(MC) 存在于与外界环境接触的组织中,如皮肤和粘膜,也存在于神经、血管和腺体旁的血管化组织中。IgE 结合可触发 MC 脱颗粒,释放生物活性预形成介质,参与对过敏原的局部或全身炎症反应。
降低血清 IgE 水平是减少过敏表现的一种机制。奥马珠单抗于 2003 年首次获美国批准,是一种人源化单克隆抗体,可结合血清 IgE 并阻断对过敏原刺激的早期和晚期反应,具有公认的有效性和安全性,可减轻症状、减少发作频率并减少类固醇需求。
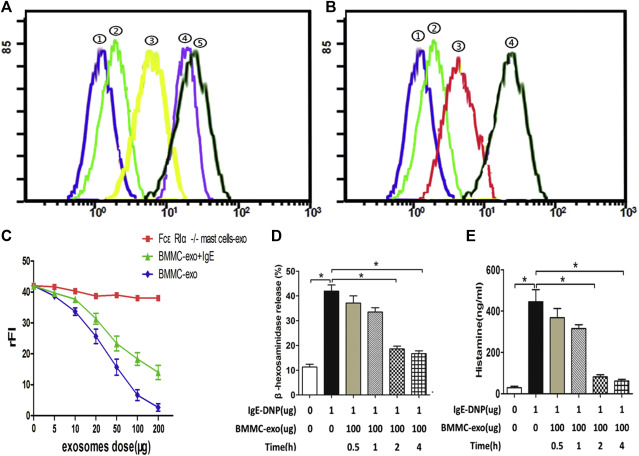
外泌体与IgE的结合
此外,有报道称从 MC 分泌组分离的外泌体可通过与 IgE 结合来抑制过敏反应。
外泌体是细胞外纳米大小的结构,以细胞膜为界,携带一系列与来源细胞类型相关的生物分子。
含有高亲和力 IgE 受体 (FcεRI) 的 MC 外泌体可结合游离血清 IgE 并降低过敏哮喘小鼠模型中的 IgE 水平。这导致 MC 活化被抑制并且气道炎症被调节,因此 MC 外泌体被提议作为一种新型的抗 IgE 剂。
外泌体是细胞间通讯的重要参与者,因为它们含有生物活性分子,如蛋白质、脂质介质和核酸,特别是微小 RNA(miRNA),它们一旦释放到细胞外空间就会调节受体细胞的活性。
在过敏中,外泌体和 miRNA 预计在病理状态的发展和维持中发挥重要作用。
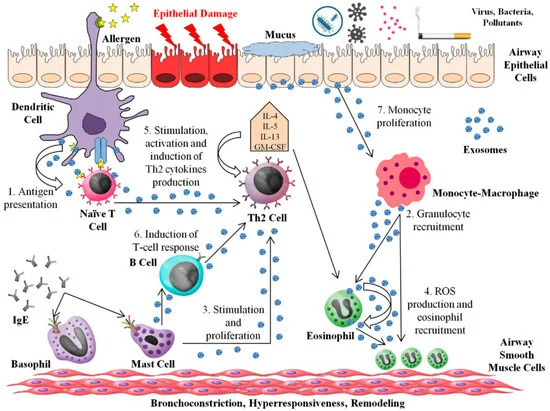
外泌体在过敏和哮喘中的作用示意图
已知有多种细胞类型会释放外泌体,其特定内容可能在过敏反应的协调中发挥核心作用。
来自树突状细胞的外泌体携带空气过敏原并导致过敏性炎症,同时 MHC 分子能够刺激 T 细胞反应。
来自微血管内皮细胞的外泌体通过 T 细胞独立机制刺激纯化的 B 细胞产生 IgE。
携带 MHC II 类、共刺激分子(CD40、CD80 和 CD86)和整合素的 B 细胞来源的外泌体可诱导 T 细胞反应。
外泌体也被认为是耐受性获得过程中的参与者。
有人提出,食物的口服耐受性是由具有免疫调节功能的外泌体 (耐受体) 介导的,这种外泌体表达主要组织相容性复合体 II 类分子 (MHCII)。
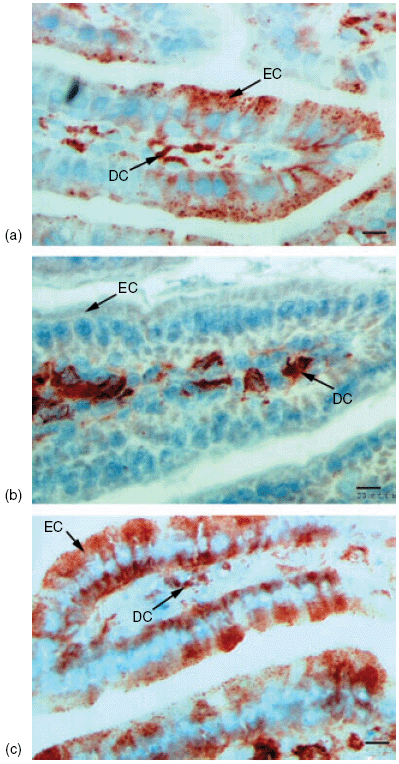
小鼠小肠上皮细胞 (IEC) 中主要组织相容性复合体 II 类分子 (MHCII) 的表达
在小鼠过敏模型中,从喂食过敏原的小鼠血清中收集外泌体,然后转移到受体小鼠体内,从而产生了过敏保护作用。
耐受体的这种过继转移是利用外泌体控制过敏性疾病最有前途的方法之一。外泌体因其多功能性、生物相容性、克服生物屏障的能力以及作为药物递送载体的潜在用途,越来越多地被认可为一种治疗工具。
与其他基于过敏原特异性细胞的干预措施不同,MSC 疗法以不依赖过敏原的方式调节免疫系统,从而尽可能减少过敏反应,而不是对特定过敏原脱敏。
在过敏性疾病模型中,MSC 治疗可通过多种机制控制加剧的免疫反应并减轻临床症状。
例如,在小鼠过敏性气道炎症模型中,全身注射骨髓来源的 MSC 后,Th2 反应转变为 Th1 反应。
同样,在过敏性鼻炎模型中,来自脂肪组织的 MSC 有助于下调 Th2 反应并减少鼻粘膜嗜酸性炎症。
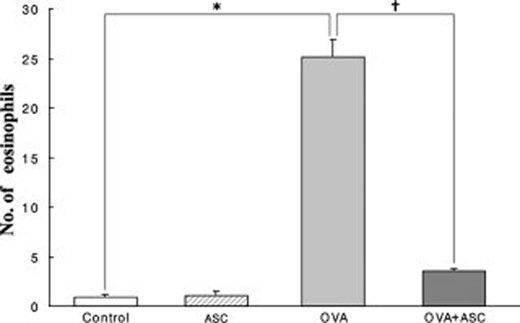
鼻粘膜中的嗜酸性粒细胞数量
广泛研究表明,MSC 在全身给药后具有向炎症部位迁移的能力。
在小鼠接触性超敏反应 (CHS) 模型中,MSC 中 CXCR5 的过表达 (MSC CXCR5 ) 显著提高了静脉输注的 MSC 向受损组织中表达的 CXCL13 的迁移能力。
MSC CXCR5 显著改善了小鼠的 CHS,受刺激皮肤中炎症细胞浸润减少和促炎细胞因子产生减少就是证据。 MSC CXCR5 抑制 T 细胞增殖并促进 T 细胞凋亡。
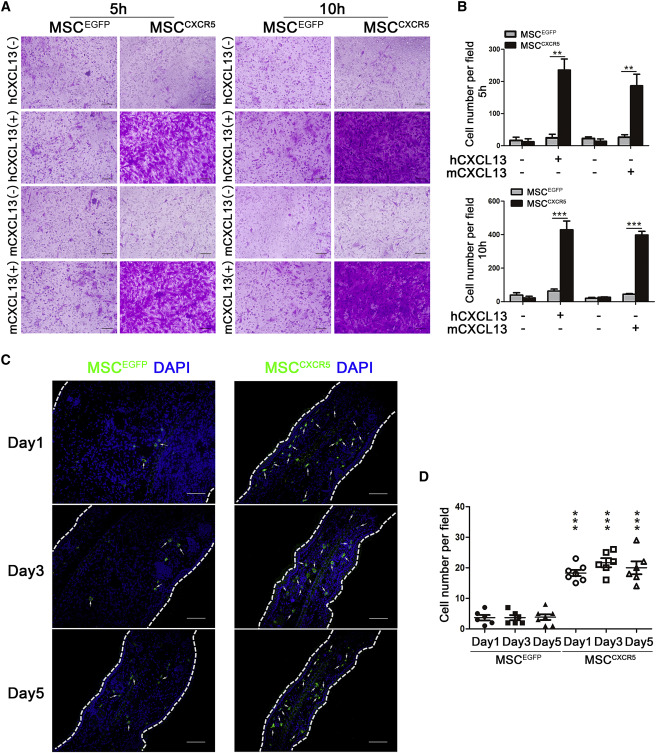
MSC CXCR5在体外表现出向 hCXCL13 和 mCXCL13 的迁移增强,在体内则表现出向发炎耳朵的迁移增强
越来越多的证据表明,MSC 的主要治疗作用是通过分泌的生物活性分子以旁分泌/自分泌形式发挥的。
已知 MSC 能释放各种可溶性因子来引起免疫抑制反应,包括:
前列腺素 E2、吲哚胺 2,3-双加氧酶 (IDO)、血红素加氧酶-1 (HO-1);TGF-β、IL-10、白血病抑制因子 (LIF)、人类白细胞抗原 (HLA)-G5、一氧化氮 (NO)、肿瘤坏死因子刺激基因 6 (TSG-6)、白细胞介素 (IL)-6 和白细胞介素 1 受体拮抗剂。
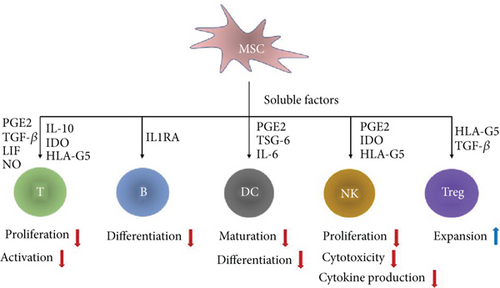
MSC 介导免疫抑制的可溶性因子示意图
将 MSC 暴露于不同的环境条件可以调节分泌蛋白组。研究发现:
MSC 分泌蛋白组在暴露于炎性细胞因子(TNF-α 和 IFN-γ)后,具有增强的免疫调节特性。
在过敏性结膜炎中,用经 TNF-α 处理的 MSC 培养基治疗,通过减少结膜中的炎性细胞浸润和抑制 COX-2 依赖机制中的 B 细胞和 MC,发挥了抗过敏作用。
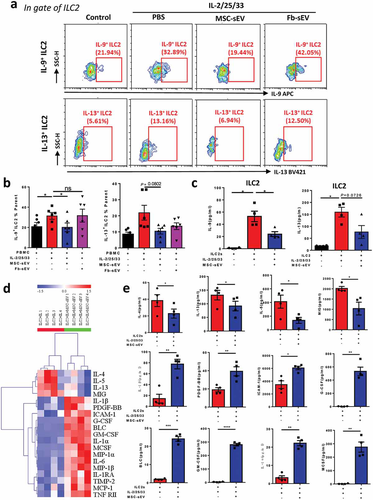
MSC-sEV在体外显着抑制了人 ILC2 的功能
细胞外囊泡也可用作低免疫原性和高生物安全性的无细胞治疗剂。
MSC 衍生的小细胞外囊泡 (sEV) 已用于哮喘小鼠模型。全身给药 MSC-sEV 可降低 ILC2 水平、炎症细胞浸润,以及减少肺部粘液产生、Th2 细胞因子,并缓解气道高反应性。
新型过敏治疗方法的关键问题是如何维持和恢复耐受性。特异性免疫疗法已发展出多种方式,部分耐受性的重建也是可能的。此类治疗策略背后的驱动机制是诱导过敏原特异性调节亚群的 T 细胞和 B 细胞。
然而,对某些过敏原反应严重且疗效低下的患者的安全问题凸显了需要在该领域进行更多研究。对于治疗用途,细胞疗法为未来发展提供了良好的前景。




全部评论