 首页
首页 我的学习
我的学习 我的
我的系统性红斑狼疮(SLE)是一种慢性自身免疫性疾病。尽管既往研究表明 SLE 与免疫系统细胞失衡有关,包括 B 细胞、T 细胞和树突状细胞等,但SLE发病机制尚不明确。因此,SLE缺乏有效且副作用较小的治疗方法。
近年来,间充质干细胞(MSC)治疗自身免疫性疾病,特别是SLE越来越受到关注。该疗法通过促进 Th2 和 Treg 细胞增殖,抑制 Th1、Th17 和 B 细胞等活性,改善难治性 SLE 的体征和症状。
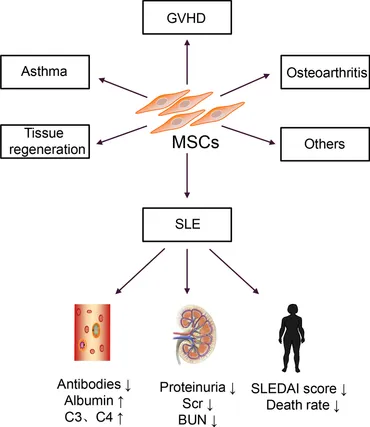
MSCs 的临床应用
MSC 的免疫抑制作用对于 MSC 治疗至关重要。MSC 可以表达 PGE2、TGF-β、NO、CCL2 、IDO、IL-10、PD-L1 和 PD-L2。
移植的 MSCs 可以通过细胞间接触作用于组织或器官,分泌细胞因子和细胞外囊泡(EVs),进一步抑制促炎细胞因子的产生,发挥免疫抑制作用。
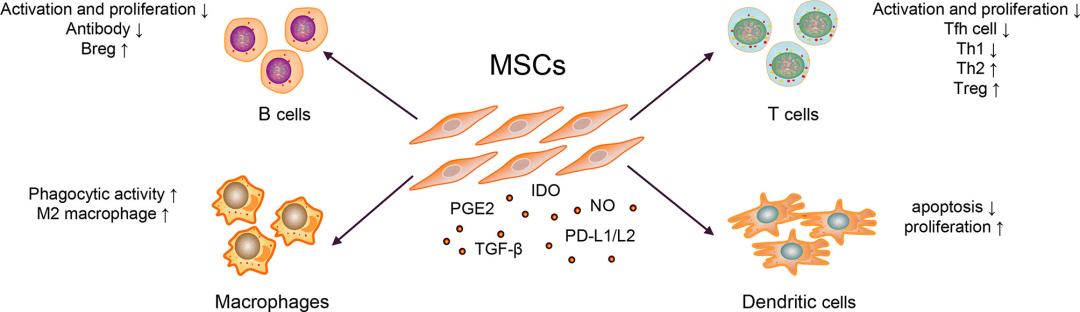
MSC 治疗 SLE 的机制
SLE 患者体内异常活化的 B 细胞具有多种功能,例如产生大量自身抗体(如抗 dsDNA 和 ANA)、分泌促炎细胞因子(如IL-6 和 IFN-γ)和抗炎细胞因子(如IL-10 和 TGF-β)。MSC 可通过可溶性因子和涉及 PD-1/PD 配体途径的细胞间接触抑制 B 细胞分化为浆细胞和抗体产生。
在 SLE 中,调节性 B 细胞 (Breg) 至少部分地通过产生 IL-10 和 TGF-β 发挥免疫抑制功能。MSC 可诱导 Breg 扩增并抑制小鼠狼疮模型中的过度炎症反应。
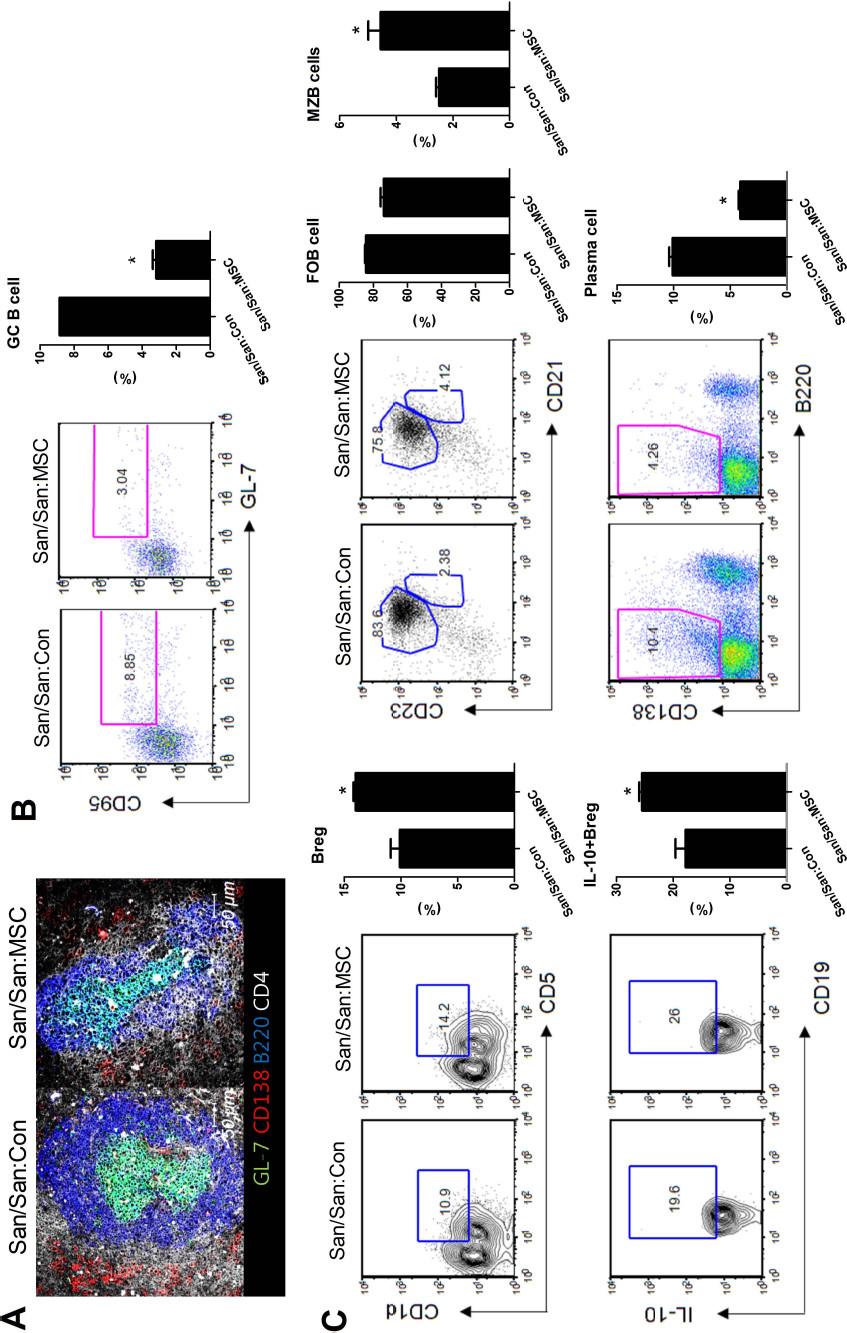
人类脂肪来源的 MSC 减少Roquin san/san
小鼠的生发中心 (GC) B 细胞和浆细胞,但增加 Breg 细胞
T 细胞的异常活化、Th1/Th2 等细胞亚群失衡是 SLE 的发病机制一般参与因素。SLE 患者血清中 IL-17 明显高于健康对照者,且与 SLEDAI 评分呈正相关。
文献报道,滤泡辅助 T 细胞(Tfh)可帮助 B 细胞产生自身抗体、形成免疫复合物,导致组织器官损伤,加重 SLE 患者的病情。
MSCs 通过细胞间接触和 iNOS 的激活,抑制幼稚 CD4 + T 细胞向 Tfh 细胞分化,减少 IL-21 的产生,减轻狼疮性肾炎,延长狼疮倾向小鼠的生存期。
另外,研究表明,MSCs 可剂量依赖性地抑制 T 细胞活化,抑制 CD4 + T 细胞向 Th1 、Th17 和 Tfh 细胞分化,促进 Treg 增殖和分泌 IL-10,降低 Th1/Th2 的比例,恢复 Treg/Tfh 细胞比例,从而纠正 SLE 患者体内异常活化的 T 细胞及细胞亚群。
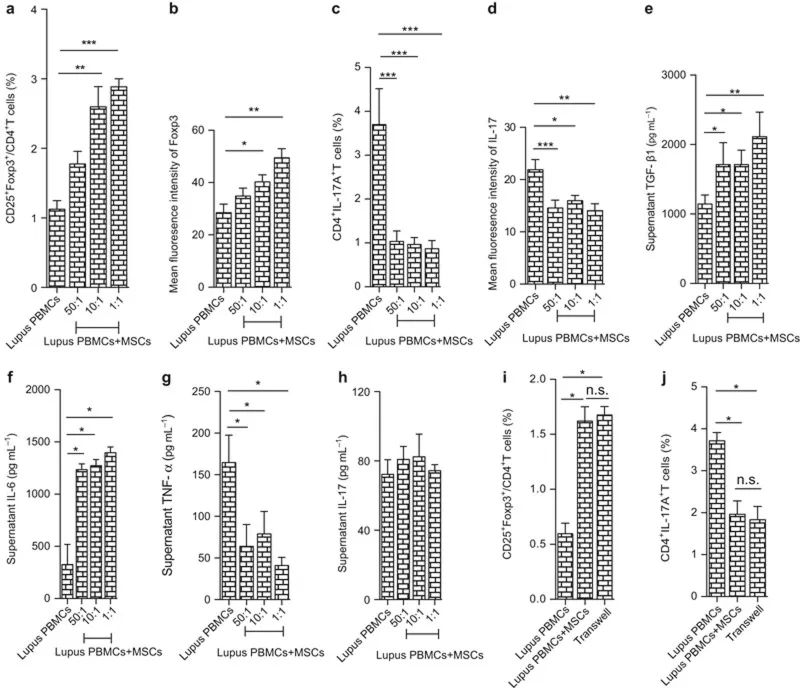
UC MSCs 在体外上调狼疮患者 Treg 细胞并下调 Th17 细胞。
另外,有报道称 30 例难治性 SLE 患者接受人脐带 MSCs 治疗 3 个月后,外周血 Treg 亚群和 TGF-β 水平升高,而 Th17 细胞及 IL-17、TNF-α 等促炎因子表达水平显著降低。
他们进一步将人脐带 MSC 与 SLE 患者外周血单个核细胞共培养,发现 MSC 在体外能够以剂量依赖性的方式上调 TGF-β 和 Treg 细胞的表达。
研究人员还在动物实验中将 MSC 与泼尼松、地塞米松、环孢素 A、霉酚酸酯和雷帕霉素 5 种 SLE 临床药物联合使用,这些药物能够增强 MSC 的治疗效果,从而增强 Treg 的功能,减轻药物的细胞毒性。



全部评论